AlphaFold 3在预测生物分子的结构和相互作用方面取得了突破性进展,其预测精度相比现有方法至少提高了50%。这项技术不仅能够模拟蛋白质结构,还能模拟DNA、RNA以及药物配体等大型生物分子,并预测其在空间中的相互作用关系,为药物发现和疾病治疗提供了新的视角。

图片来源:https://blog.google/technology/ai/google-deepmind-isomorphic-alphafold-3-ai-model/#life-molecules
AlphaFold 3的问世引起医药研发、疾病治疗领域的轰动,特别是在抗体药物开发中,需要精确了解抗体与其目标分子之间的相互作用,这是决定药物疗效的关键。AI技术为我们发现抗原抗体相互作用带来了巨大提速,但抗体药研发是一项复杂的科学工程,我们依然面临许多挑战。
治疗性抗体药竞争激烈,企业研发如何脱颖而出
2023年,FDA批准了12种新的抗体药物上市,其中包括8种单克隆抗体和4种双特异性抗体。
在这批新批准的单抗药物中,值得一提的是渤健制药开发的仑卡奈单抗(Lecanemab)。这款药物针对β-淀粉样蛋白,是阿尔茨海默病治疗领域的重要突破。据预测,仑卡奈单抗的市场销售额将达到18.67亿美元,将成为该领域重磅炸弹级新药。
在双特异性抗体药物方面,2023年在血液肿瘤领域有多款新药获批上市。例如,Elrexfio和Talvey是用于治疗多发性骨髓瘤的新药,分别针对BCMA/CD3和GPRC5D/CD3靶点。此外,Epkinly和Columvi是用于治疗大B细胞淋巴瘤的新药,均靶向CD20和CD3。
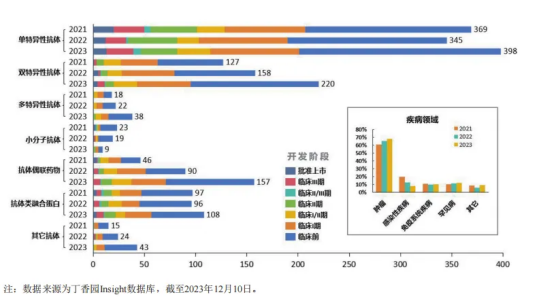
不同类型的抗体类新药开发进展及疾病领域
从近年来开展临床试验的抗体类型来看,单特异性抗体仍是抗体药物研发的焦点,其临床研究热度在近三年内并无显著变化。双特异性、多特异性抗体和抗体偶联药物领域的研究热度呈现上升趋势,但多特异性抗体仍占据较小比例。
从靶点选择上来看,目前已上市的抗体药物主要是针对PD-1/L1、HER2、CD20、TNF-α、IL-6等热门靶点。其中,PD-1/L1是近年来最热门的靶点之一,呈现出激烈竞争的态势。


Nature Reviews Drug Discovery 20, 10 (2021)
先进生物分析技术,突破抗体药研发难点
尽管抗体药物的发展前景广阔,但在研发过程中仍面临着诸多挑战。
1.新靶点难以开发
抗体药物的开发过程中,首要挑战之一就是新靶点的开发。尽管已经有许多已知的药物靶点,但是在某些疾病,特别是一些罕见疾病和复杂的多因素性疾病中,仍然缺乏有效的靶点。此外,对于已知的靶点,也需要进一步研究其在疾病发生和发展中的作用,以便开发出更有效的抗体药物。
在这一过程中,先进的生物分析技术发挥着至关重要的作用。2023年Cancer Research发表了一篇关于针对EGFR/HER3靶点的创新双特异性抗体药物偶联物BL-B01D1的文章,研究表明BL-B01D1在多种癌症(如非小细胞肺癌 (NSCLC) )的I期临床试验中表现出优异的疗效。

BL-B01D1来源于SI-B001(也称为SI-1X6.4)四价双特异性抗体,专利CN116490523A描述了采用Octet® 非标记分子互作系统高通量地分析与准确地表征SI-1X6.4的结合活性。在亲和力检测的基础上,Octet® 还验证了SI-1X6.4具备同时结合HER3与EGFR靶点的特性,从而实现双特异性抗体1+1>2的协同作用。
Octet® 非标记分子互作系统能够测量抗体与其靶标之间的相互作用,包括结合亲和力、动力学参数以及浓度依赖性分析。这些信息对于理解抗体与新靶点的相互作用至关重要,有助于筛选和优化潜在的抗体药物候选物。

2.筛选效率低下
抗体药物研发通常需要大规模筛选,以确定最具活性和选择性的候选药物。然而,传统筛选方法效率低,耗时耗力。随着技术的发展,一些新的高通量筛选技术已经开始应用于抗体的筛选过程。
ImmunoPrecise Antibodies公司采用iQue® 高通量流式细胞仪和ForeCyt® 软件,优化了单克隆抗体的发现流程,显著提高了单克隆抗体发现的效率。这项高通量技术能够快速检测大量细胞克隆的抗原表达,在5分钟内完成96孔板的检测,极大缩短了筛选时间。在血清评估阶段,将近2,500份血清样品通过独特的编码技术进行了抗体结合评估,确保了抗体的特异性。在杂交瘤筛选过程中,通过多重细胞结合分析,9,600个杂交瘤克隆的上清液在一天内完成了抗体结合和特异性的测定。

这些技术的应用不仅加快了抗体Leads的产生,还通过“微型化”分析模式降低了成本,节省了宝贵的抗体上清液,为后续的验证性或功能性研究提供了资源。
iQue® 高通量流式细胞仪加速靶点筛选流程:
·快速分析多参数:iQue® 可以在单个实验中分析多个标记物,这有助于识别和确认疾病相关的特定细胞表面标记物。这种多参数分析能够处理大量样本,提供关于不同细胞群体的详细信息。
·高通量筛选:iQue® 能够快速筛选大量的细胞样本和抗体,这有助于快速锁定具有治疗潜力的抗体候选物。处理 96 孔板仅需 5 分钟,或在 20 分钟内处理384 孔板。
·微量化:独特的采样技术,可以从微量样本中采样,最少只需一微升, 节约珍贵的样本和试剂。

3.开发中的工艺优化
在抗体开发过程中,抗体表达需要进行哺乳动物细胞培养液收获的实验。处理哺乳动物细胞培养液极为困难,经常需要快速完成任务,同时尽可能减少细胞培养液的损失。
在实验室规模的澄清过程中,最广泛采用的方法是先进行离心,然后用0.2, 0.22或0.45 μm 过滤器过滤清除的上清液。传统的离心和过滤过程存在速度慢、易堵塞、处理量低、质量差(如内毒素污染)等的局限性。
Sartoclear Dynamics® Lab套装专为实验室而设计,可快速收获15 mL至1,000 mL体积的细胞培养液,免去澄清所需的离心步骤,一步完成澄清和除菌过滤。几分钟内就能轻松快速地澄清和除菌多达1,000 mL的细胞培养液。

寻找下一代抗体发现的新方向
面对现有挑战,科研界正在积极探索新的技术路径。其中,高通量单B细胞克隆技术和人工智能(AI)辅助的抗体设计成为了研发新一代抗体药物的两大前沿方向。
1.高通量单B细胞克隆技术
在抗体发现中,使用免疫动物并将其免疫B细胞永生化为杂交瘤是传统的方法之一,但这种方法存在一些劳动密集、耗时和吞吐量有限的缺点。因此,直接挖掘原代B细胞抗体库的技术对于抗体发现越来越重要,高通量单B细胞克隆技术应运而生。
高通量单B细胞克隆技术通过从免疫动物中提取B细胞,并利用高通量筛选技术快速、准确地分析大量单个B细胞的抗体基因序列,有助于我们挖掘更多潜在的抗体候选物。
最近的一篇来自于牛津大学的文章中,作者使用CellCelector全自动无损细胞分离系统作为分离原代B细胞以发现抗体的平台。该研究筛选了CD138+ B细胞的子集,在1189个抗体分泌细胞 (ASC) 中鉴定出238个潜在的EGFR特异性B细胞,并通过CellCellector成功筛选并分离出94个高产量阳性克隆。鉴定了一组不同的重链互补决定区序列,并将其中20个克隆表达为标准人免疫球蛋白G1抗体形式。进一步表征并鉴定了13种结合可溶性和天然形式EGFR的重组抗体。
通过将该方法扩展至从一种EGFR免疫的XenoMouse®(首批完全人类转基因抗体生成动物之一)中提取的所有400,000个CD138+ B细胞,研究人员发现了潜在的1196种独特的EGFR特异性抗体。CellCelector平台的优势在于能够分离特定感兴趣的治疗靶点的B细胞。此外,从分离的B细胞中回收的抗体序列成功结合可溶性和天然形式的EGFR,进一步验证了CellCellector作为一种有效的抗体发现平台的潜力。

代表性荧光和明场图像,展示了从纳米孔中挑选一个EGFR+ ASC并将其转移到含有裂解缓冲液的96孔PCR板的B1孔中进行分子回收。图像居中并自动分配绿色轮廓到要挑选的孔和B细胞。
(A)647 nm特异性荧光发射(红色)的图像,可以观察到两个相邻的孔包含ASC。(B)488 nm特异性荧光发射(绿色)的图像,可以观察到一个相邻的孔包含特异于EGFR的ASC。(C)647 nm和488 nm通道图像的叠加图像,以及(D)用于挑选EGFR+ ASC的明场图像。明场图像(E)在从纳米孔中挑选EGFR+ ASC之前,以及(F)在挑选之后。明场图像显示纳米孔内的所有内容物都被挑选出来。
由此可见,赛多利斯的CellCelector系统结合了独特的纳米孔技术和高通量细胞筛选、成像、灵敏的单细胞测定以及精准细胞分离功能,使得在同一天内处理数千个血浆单B细胞成为可能。通过单细胞分析,CellCelector能够检测到传统筛选方法难以发现的稀有抗体特性。该系统的荧光筛选功能具有高灵敏度和多通道检测能力,能够实时获取并分析荧光图像,精确识别目标B细胞。CellCelector还支持立即对单个细胞进行多种测试分析,避免了传统方法中需要培养数周以获得足够细胞数量的步骤。这些特点使得CellCelector在B细胞筛选和单克隆抗体筛选中表现出色,广泛应用于抗体发现、免疫监测和单细胞研究等领域。

·全自动无损细胞分离系统实现自动化单B细胞及分泌物筛选和分离
·CellCeIector与独特的纳米孔技术相结合,并将高通量细胞扫描成像、分析筛选、单细胞和克隆自动化分离结合,实现了同一天共同处理数万个血浆单B细胞的操作
·CellCeIector基于精准且温和的机械挑取模式,确保细胞的高存活率

2.人工智能(AI)辅助的抗体设计
人工智能在抗体设计领域的应用展现出了巨大的潜力。AI技术可以帮助我们预测和模拟抗体与抗原的相互作用,从而加速抗体设计的过程。通过机器学习算法和大数据分析,AI可以帮助我们优化抗体的亲和性、特异性和稳定性,进而设计出更加高效和理想的抗体药物。
艾诺森、义翘神州和南方研究院的合作研究表明,AI设计的抗体能够针对多种SARS-CoV-2毒株提供广泛中和能力。在这项研究中,研究团队通过整合多种数据类型和处理策略,如机器学习、自然语言处理、蛋白质结构建模和蛋白质序列语言建模,成功生成了SARS-CoV-2的数字孪生,并计算设计针对1300多种不同SARS-CoV-2历史毒株的广泛中和抗体。这些毒株在受体结合域(RBD)区域包含64个突变。经过实验验证,AI设计的抗体在针对多种毒株的真实病毒中和测定中表现出良好效果,包括最新的Omicron毒株。许多抗体在ELISA测定中展现出对多种毒株RBD的强大结合能力。

基于人工智能的 SARS-COV-2 广泛中和抗体设计
这些结果为塑造未来病毒株的治疗设计提供了重要参考,并有助于预测病毒进化中的潜在模式。人工智能可以通过学习这些模式来开发未来的抗病毒治疗方法。
未来展望
随着生物制药设备和技术的不断进步,治疗性抗体的研发正处于快速发展之中。面对行业发展的各种挑战和痛点,采用先进的技术和综合性解决方案是提高研发效率、降低成本、保证药物质量和安全的关键。
 知科技_科技信息服务平台
知科技_科技信息服务平台

 下载客户端
下载客户端










